ELES CRIARAM UM MUNDO RECARREGÁVEL
Fonte: Popular information, Press Release: The Nobel Prize in Chemistry 2019.
Eles desenvolveram a bateria mais poderosa do mundo.
O Prêmio Nobel em Química de 2019 foi dado a John B. Goodenough, M. Stanley Whittingham e Akira Yoshino por suas contribuições ao desenvolvimento da bateria de íon de Lítio.
Esta bateria recarregável
- Estabeleceu as fundações para a eletrônica sem fio, tais como telefones celulares e laptops.
- Tornou possível um mundo livre de combustíveis fósseis, pois tem sido usada para tudo, desde carregar veículos elétricos ao armazenamento de energia de fontes renováveis.
O elemento químico Lítio
Um elemento químico raramente consegue um papel principal nos dramas da história, mas o Prêmio Nobel de Química tem um protagonista claro: o Lítio, um antigo elemento que foi criado durante os primeiros minutos do Big Bang. E que a humanidade passou a conhecer em 1817, quando os químicos suíços Johan August Arfwedson e Jöns Jacob Berzelius o purificaram de uma amostra mineral da mina Utö Mine, no arquipélago de Estocolmo.

Berzelius nomeou o novo elemento com a palavra grega para pedra, LITHOS.
Apesar de seu nome “pesado”, é o mais leve dos elementos sólidos – motivo de ninguém sentir sua presença ao carregarem seus telefones celulares por aí. Lítio é um metal. Possui apenas um elétron em sua camada eletrônica externa, e isto tem um forte efeito de liberação do elétron para outro átomo. Quando isto acontece, um íon de lítio positivamente carregado e mais estável é formado.
Para ser completamente correto – os químicos suíços não obtiveram lítio metálico puro, mas íons de lítio na forma de um sal.
Jöns Jacob Berzelius , químico sueco, (1779-1848).

O lítio puro é fonte de muitos alarmes de incêndio. Inclusive nesta história contada aqui; ele é um elemento químico instável que deve ser armazenado em óleo para que não reaja com os elementos químicos do ar. O perigo do Lítio – sua reatividade – é também sua maior qualidade.
Químico sueco Johan August Arfwedson (1792-1841) por Johan Way, 1903.
O Lítio foi descoberto em 1818 por Johan August Arfwedson, aos 25 anos de idade, quando trabalhava no laboratório de Berzelius. Em carta para C. L. Berthollet escrita em 9 de fevereiro de 1818, Berzelius relata que
“o novo álcali foi descoberto pelo Sr. Arfwedson (…) num mineral previamente descoberto pelo Sr. d’Andrada numa mina de Utö e por ele chamado de petalita (…)”
O sr. d’Andrada mencionado era ninguém mais senão José Bonifácio de Andrada e Silva, Bonifácio estudou em Coimbra, Portugal, e trabalhou com Lavoisier, Fourcroy, Laurent Jussieu, o abade Haüy, Werner e Alessandro Volta. Em carta publicada no Scherer’s Journal em janeiro de 1800, José Bonifácio aos 37 anos descreve dois novos minerais. Um denominou petalita, em homenagem ao Imperador do Brasil. O outro de espodumênio. Hoje, sabe-se que a petalita é um silicato de alumínio e lítio, LiAl(Si2O5)2.

O que os Nobelistas fizeram?
- Stanley Whittingham usou o enorme potencial do Lítio para liberar seu elétron externo ao desenvolver sua primeira bateria funcional de lítio.
- Em 1980, John Goodenough dobrou o potencial (voltagem) da bateria, criando as condições adequadas para uma bateria mais ponderosa e útil.
- Em 1985, Akira Yoshino conseguiu eliminar o lítio puro da bateria, baseando-a inteiramente com íons de lítio, que são mais seguros do que lítio puro.
Isto tornou a bateria mais funcional. E trouxe um grande potencial para a humanidade, ao permitir o desenvolvimento de computadores laptop, telefones celulares, veículos elétricos e o armazenamento de energia gerada por usinas eólicas ou fotovoltaicas.
A crise, demanda e poluição por Petróleo revitalizou a pesquisa em baterias
Em meados do século XX, a quantidade de carros a base de petróleo aumentou significativamente no mundo todo e seus gases poluentes pioraram a qualidade do ar nas grandes cidades. Isto, combinado com a crescente compreensão de que o combustível fóssil é um recurso finito, dispararam um alarme para fabricantes de veículos e companhias de petróleo.
Eles precisaram investir em veículos e fontes alternativas de energia para garantir a sobrevivência ou revolução de seus empreendimentos. E, veículos elétricos e fontes alternativas de energia requerem baterias poderosas que possam armazenar grande quantidade de energia.
Mas haviam apenas 2 tipos de baterias recarregáveis no Mercado na época:
- A bateria de chumbo ácido inventada pelo francês Gaston Planté em 1859 e desenvolvidas para veículos em 1881 por Emile Alphonse Fauré e que ainda é usada como bateria “starter” nos veículos a base de pretróleo).
- A bateria de níquel-cadmio NiCd foi criada em 1899 pelo sueco Waldmar Jungner, e desenvolvida na primeira metade do século XX.
Indústria do Petróleo investe em nova tecnologia
A crise do petróleo fez com uma gigante do mercado, Exxon, decidisse diversificar suas atividades. Em um grande investimento em pesquisa básica, eles recrutaram alguns dos pesquisadores mais eminentes no campo de energia, e lhes deu Liberdade para fazer o que quisessem – desde que não envolvesse petróleo.
Stanley Whittingham é um dos que foi trabalhar na Exxon em 1972. Ele veio da Stanford University, onde pesquisava materiais sólidos com espaços “atômicos” onde íons carregados pudessem se inserir. Fenômeno chamado intercalação química.
As propriedades dos materiais mudam quando íons são capturados por eles. Em Exxon, Stanley Whittingham e seu colegas começaram a investigar materiais supercondutores, incluindo sulfuretode tântalo (TaS2), que pode intercalar íons. Eles adicionaram íons ao disulfídio de tântalo e estudaram como sua condutividade era afetada.
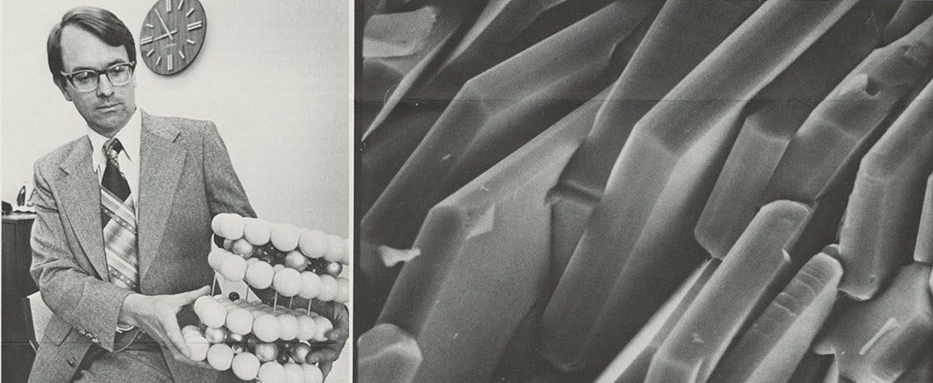
Whittingham descobre um material com enorme densidade energética
Como ocorre na Ciência, este experimento abriu as portas para uma descoberta inesperada e valiosa. Os íons de potássio afetaram a condutividade do disulfidio de tântalo e, quando Stanley Whittingham começou a estudar o material com mais detalhe, ele observou que ele tinha uma densidade energética muito alta.
- As interações que ocorrem entre os íons de potássio e o disulfidio de tântalo eram surpreendentemente ricas em energia e, quando ele mediu a voltagem do material, ele obteve um par de volts (2 V). Isto era melhor do que muitas das baterias da época.
- Stanley Whittingham rapidamente percebeu que era um momento importante, uma mudança para o desenvolvimento de nova tecnologia que pudesse armazenar energia para veículos elétricos no futuro. Entretanto, o tântalo é um dos elementos pesados e o Mercado não precisava de baterias mais pesadas – assim, ele substituiu o tântalo por titânio, elemento com propriedades semelhantes mas bem mais leve.

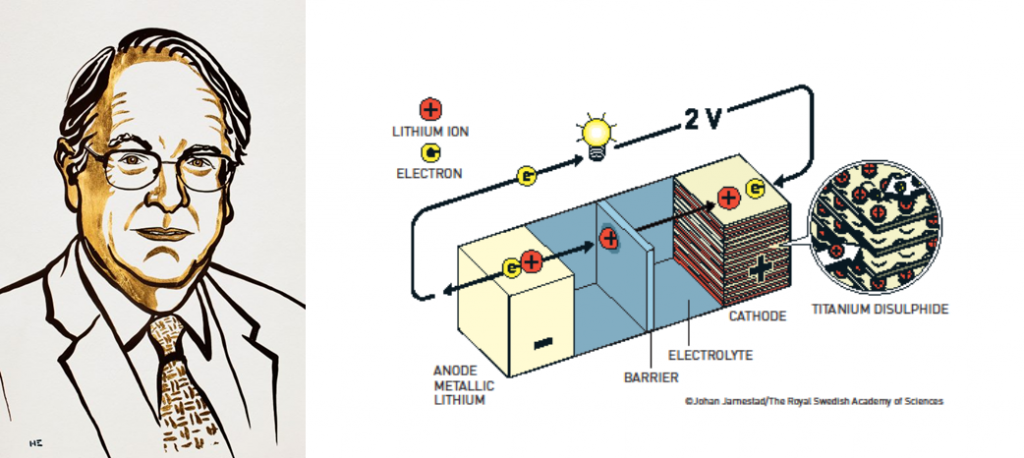
Lítio como eletrodo negativo
O Lítio entrou nessa história quando Stanley Whittingham o utilizou como eletrodo negativo em sua nova bateria. O lítio não foi uma escolha aleatória; em uma bateria, os elétrons devem fluir do eletrodo negativo – o anodo – para o eletrodo positivo – o catodo. Portanto, o anodo deve conter um material que libere facilmente seus elétrons e, de todos os elementos, o lítio é o que mais facilmente libera elétrons de sua camada externa.
O resultado foi uma bateria de lítio que:
- É recarregável.
- Funciona à temperatura ambiente.
- E, literalmente, possui um grande potencial elétrico.
Stanley Whittingham viajou para a central da Exxon em Nova Iorque para apresentar o projeto. A reunião durou cerca de 15 minutos, com a direção tomando uma rápida decisão: eles iriam desenvolver uma bateria comercialmente viável usando a descoberta de Whittingham.
A bateria explode e o preço do petróleo cai…
Infelizmente, o grupo que ia iniciar a produção da bateria sofreu alguns percalços.
Conforme a nova bateria de lítio era repetidamente carregada, finas pontas de lítio cresciam do eletrodo de lítio. E quando atingiam o outro eletrodo, a bateria sofria um curto-circuito que poderia levar a uma explosão. As brigadas de incêndio tiveram que apagar alguns incêndios e ameaçaram fazer o laboratório pagar pelos materiais usados para extinguir os incêndios de lítio. Para tornar as baterias mais seguras, alumínio foi adicionado ao eletrodo de lítio metálico e o eletrólito entre os eletrodos foi modificado.
Stanley Whittingham anunciou sua descoberta em 1976 e a bateria começou a ser produzida em pequena escala para um fabricante de relógios suíços que queria usá-la em peças funcionando à energia solar.
O próximo objetivo era escalonar a bateria de lítio recarregável para que ela pudesse acionar um veículo. Entretanto, o preço do petróleo caiu dramaticamente no início dos anos 1980s e a Exxon precisou fazer cortes em seus investimentos. O desenvolvimento do trabalho foi interrompido e a tecnologia da bateria de Whittingham foi licenciada para três empresas diferentes em diferentes países do mundo.
A crise do petróleo fez Goodenough se interessar por baterias
Quando era criança, John Goodenough voltou seu interesse para a Matemática e eventualmente – após a II Guerra Mundial – também para a Física. Ele trabalhou por muitos anos no Lincoln Laboratory do Massachusetts Institute of Technology, MIT. E enquanto estava lá, contribuiu para o desenvolvimento da memória de acesso randômico (RAM) que ainda é um componente fundamental da Computação.

John Goodenough, em fotografia de 1967, líder na época do Electronic Materials Group no MIT Lincoln Laboratory.
John Goodenough, como muitos outros nos anos 1970s, foi afetado pela crise do petróleo e queria contribuir para o desenvolvimento de fontes alternativas de energia. Entretanto, o Lincoln Laboratory foi fundado pelas forças armadas US Air Force e não permitia todo tipo de pesquisa. Deste modo, ao receber um convite para trabalhar como professor de química inorgânica na Oxford University na Grã-Bretanha, ele aceitou sem hesitar e ingressou no importante mundo da pesquisa em energia.
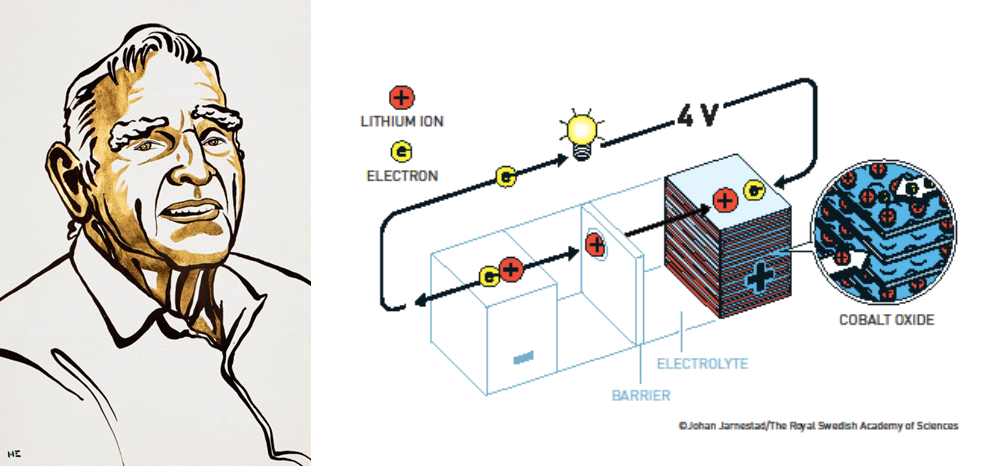
Altas voltagens quando os íons de lítio eram acopladas a óxido de Cobalto.
John Goodenough sabia da bateria revolucionária de Whittingham, mas o seu conhecimento especializado da matéria lhe dizia que seu catodo teria um potencial elétrico maior se ele fosse construído usando um óxido metálico em vez de um sulfídio metálico.
Algumas pessoas em seu grupo de pesquisa foram encarregadas de encontrar um óxido metálico que produzisse uma alta voltagem quando intercalasse íons de lítio, mas que não entrassem em colapso quando os íons fossem removidos. Essa linha de pesquisa acabou tendo mais êxito do que John Goodenough havia imaginado.
A bateria de Whittingham gerou cerca de 2 Volts, mas Goodenough descobriu que a bateria com lítio-óxido de cobalto no catodo era quase duas vezes mais eficiente, chegando a 4 Volts.
Uma chave para este sucesso foi a percepção de John Goodenough de que as baterias não precisavam ser fabricadas em seu estado carregado, como havia sido feito previamente. Em vez disso, elas podiam ser carregadas posteriormente. Em 1980, ele publicou a descoberta deste novo conceito, materiais catodos de densa energia, que, apesar de seu pouco peso, resulta em baterias poderosas de alta capacidade.
Este foi um passo decisivo para a revolução sem fio.
Industrias japonesas queriam baterias mais leves para a Nova Eletrônica
No Ocidente, conforme o petróleo voltava a ficar mais barato, reduziam os investimentos em tecnologia de energias alternativas e pelo desenvolvimento de veículos elétricos.
Entretanto, as coisas eram diferentes do outro lado do planeta, no Japão; a indústria de eletrônica estava desesperada por baterias recarregáveis e leves que pudessem acionar a eletrônica inovativa emergente, tais como câmeras de vídeo, telefones e computadores sem fios.
Uma pessoa que percebeu essa necessidade foi Akira Yoshino da Asahi Kasei Corporation. Ou, como ele mesmo disse:
“Eu apenas senti o cheiro da direção que as novas brisas (tendências) estavam seguindo. Você pode dizer que eu tenho um bom senso de olfato.”
Yoshino constrói a primeira bateria de íon de lítio comercialmente viável

Quando Akira Yoshino decidiu desenvolver uma bateria recarregável funcional, ele tinha o óxido de cobalto-lítio de Goodenough como o catodo e tentou usar vários materiais a base de carbono como o anodo.
As pesquisas tinham previamente mostrado que os íons de Lítio podiam ser intercalados em camadas moleculares no grafite, mas o grafite era quebrado pelo eletrólito da bateria. O momento “Eureca!” de Akira Yoshino foi quando ele decidiu mudar a utilização “petroleum coke”, um subproduto da indústria do petróleo. Quando ele carregou o “petroleum coke” com elétrons, os íons de lítio foram liberados para o material. Então, quando ele ligou a bateria, os elétrons e íons de lítio fluíam para o óxido de cobalto no catodo, que tem um potencial elétrico bem maior.
A bateria desenvolvida por Akira Yoshino:
- É estável,
- É leve,
- Possui uma alta capacidade.
- Produz incríveis quatro Volts, (4 V).
A maior vantagem da bateria de íon-lítio é que os íons são intercalados nos eletrodos. A maioria de outras baterias era baseada em reações químicas nas quais os eletrodos são lentamente, mas certamente modificados (alterados). Quando uma bateria de íon de lítio é carregada ou usada, os íons fluem entre os eletrodos sem reagir com sua vizinhança. Isto significa que a bateria possui uma vida maior e pode ser carregada centenas de vezes antes de seu desempenho deteriorar.
Outra grande vantagem é que a bateria não possui nenhum Lítio puro.
Em 1986, quando Akira Yoshino estava testando a segurança das baterias, ele tinha protocolos de proteção e usava um equipamento projetado para testar aparelhos explosivos.
Ele soltou um grande pedaço de ferro sobre a bateria, mas nada aconteceu. Entretanto, ao repetir a experiência com uma bateria que continha Lítio puro, houve uma violenta explosão.
Passar em testes de segurança foi fundamental para o futuro da bateria.
Akira Yoshino disse que isto foi “o momento em que a bateria de íon de lítio finalmente nasceu”.
A bateria de íon de lítio: necessária para uma sociedade livre de combustíveis fósseis!?
Em 1991, uma grande empresa de eletrônicos japonesa começou a vender as primeiras baterias de íons de lítio, abrindo as portas para uma Revolução na Eletrônica.
- Os telefones celulares encolheram,
- computadores se tornaram portáteis.
- e Players MP3 e Tablets foram desenvolvidos.
Consequentemente, os pesquisadores em todo o mundo começaram a caçar os elementos da Tabela Periódica, procurando encontrar baterias ainda melhores, mas ninguém conseguiu ainda inventor algo que ultrapasse a alta capacidade e voltagem da bateria de íons de lítio.
Desde então, a bateria de íons de lítio tem sido modificada e melhorada; entre outras coisas, John Goodenough substituiu o óxido de cobalto por fosfato de ferro – o que tornou a bateria ambientalmente mais amigável. Como quase tudo mais, a produção de baterias de íons de lítio possuem um impacto sobre o ambiente, mas também há grandes benefícios ambientais (comparada às demais).
•A bateria permitiu o desenvolvimento de tecnologias e veículos elétricos mais limpos, contribuindo para a redução da emissão de gases do efeito estufa e de partículas. Por meio de suas pesquisas e sonhos, John Goodenough, Stanley Whittingham and Akira Yoshino criaram as condições adequadas para uma Sociedade Sem Fio e Sem Combustíveis Fósseis, com grande benefícios ao ambiente e à humanidade.
Para saber mais:
- Press release: The Nobel Prize in Chemistry 2019: Scientific Information.

